Carbohidratos
1. Definición
Los carbohidratos son una de las clases principales de compuestos orgánicos y a muchos de ellos se les llama "azúcares". Son biomoléculas que proporcionan la mayor parte de la energía que mantiene trabajando el motor humano. Son compuestos formados por carbono, hidrógeno y oxigeno aunque a veces se puede encontrar átomos como nitrógeno, azufre y fósforo; en muchos casos corresponden a la formula Cn(H2O)m.
Los carbohidratos son compuestos que contienen cantidades grandes de grupos hidroxilo. Los carbohidratos más simples contienen una molécula de aldehído (polihidroxialdehídos) o una cetona (polihidroxicetonas).
2. Clasificación
Los carbohidratos se pueden clasificar en monosacáridos, disacáridos, oligosacáridos y polisacáridos.
Un monosacárido es un carbohidrato simple, que al ser hidrolizado no se rompe en carbohidratos menores.

Contienen entre 3-7 carbonos, son solubles en agua, presentan un sabor dulce y son sólidos, blandos y cristalinos. Un ejemplo es la glucosa. Los disacáridos son carbohidratos que se rompen por hidrólisis formando dos monosacáridos que pueden ser iguales o diferentes. La sacarosa, el azúcar común, es una disacárido que, por hidrólisis, forma una molécula de glucosa y una de fructosa.
Un oligosacárido es un carbohidrato que produce dos o más monosacáridos por hidrólisis y contiene de 2 a 10 monosacáridos. Los polisacáridos son carbohidratos que se hidrolizan y forman "muchos" monosacáridos. La diferencia entre oligo y polisacáridos es que cada molécula de un oligosacárido en particular tiene la misma cantidad de unidades de monosacáridos unidas entre sí en el mismo orden que cualquier otra molécula del mismo oligosacárido. Casi siempre, los polisacáridos son mezclas de moléculas que tienen una longitud similar, pero no necesariamente igual.
Finalmente, se conocen mas de 200 monosacaridos distintos, que se agrupan según si son
polihidroxialdehídos o polihidroxicetonas. Los que pertenecen al primer grupo se llaman aldosas y los otros se llaman cetosas. Las aldosas y las cetosas se subdividen según sea la cantidad de átomos de carbono en la cadena principal.
Debido a que todos los carbohidratos tienen átomos carbono quirales, se reconoció que era necesario un método estándar de representación para describir la estereoquímica de los carbohidratos.
En 1906, M. Rosanoff sugirió que se asignara una configuración al (+)-gliceraldehído y se correlacionaran con ella las otras configuraciones de los azúcares. La configuración que se escogió para esta molécula fue la que ahora se llama R, y por ello al (-)-gliceraldehído se le asigno la configuración S.

Se decidió que el R-(+)-gliceraldehído tomara el nombre de D-gliceraldehído (porque es dextrógiro) y su enantiómero L-gliceraldehído (porque es levógiro).
Casi todos los monosacáridos que se encuentran en la naturaleza tienen la misma configuración estequiométrica R que el D-gliceraldehído en el centro de quiralidad más alejado del grupo carbonilo y, en las proyecciones de Fisher, presentan el grupo hidroxilo del ultimo carbono quiral a la derecha. Por esta razón todos esos azúcares se conocen como azúcares D. En contraste con los azúcares D, los azúcares L tienen una configuración S en el último carbono quiral con el grupo -OH apuntando hacia la izquierda en las proyecciones de Fisher. Así un azúcar L es la imagen especular de uno D y tiene configuración opuesta a dicho azúcar en todos los centros de quiralidad.
Se observa así que las notaciones D y L no tienen relación con la dirección en que un azúcar dado hace rotar la luz polarizada en un plano. Un azúcar D puede ser dextró o levógiro; D indica solamente que el grupo -OH del ultimo carbono quiral está a la derecha cuando se dibuja en una de las proyecciones de Fisher, además que no dice nada respecto a la configuración de otros posibles centros de quiralidad.
Finalmente para cada n centros de quiralidad existen 2n enantiómeros.
4. Reacción de ciclación
Las aldosas y las cetosas, principalmente de 5 o 6
átomos de carbonos, cuando se encuentran en solución acuosa se
ciclan formando anillos de 5 y 6 vértices. Esto es posible gracias a
la presencia de los grupos funcionales C=O y -OH que son capaces de
reaccionar entre sí formando un hemiacetal cíclico. A los
hemiacetales cíclicos de 5 vértices se les llama formas de
furanosa, y a los de 6 se les llama formas de piranosa. El carbono
del anillo que se deriva del grupo carbonilo, es decir, el que tiene
dos sustituyentes oxígeno, se llama carbono anomérico.
En todas las aldosas, la formación del hemiacetal entre
el aldehído y el alcohol del ultimo átomo de carbono asimétrico
produce el anillo de furanosa. El carbono anomérico es un nuevo
centro de quiralidad y su grupo hidroxilo puede ser cis o trans
respecto a los grupos de la molécula.
Las
dos formas estereoisoméricas de la D-eritrosa se llaman
α-D-eritrofuranosa
y β-D-eritrofuranosa, donde α y β indican la configuración
relativa
del carbono anomérico.
Configuración
relativa: En
química se usa una versión informal de las reglas IUPAC para
asignar α
y β, que es valida para carbohidratos:
1- Se orienta la
formula de Haworth del carbohidrato con el oxígeno del anillo hacia
atrás, y el carbono anomérico a la derecha.
2- Para carbohidratos
de la serie D, la configuración del carbono anomérico es α si su
grupo hidroxilo está hacia abajo y β si el grupo hidroxilo del
carbono anomérico está hacia arriba.
3- Para los
carbohidratos de la serie L, la configuración es α si el grupo
hidroxilo está hacia arriba, y β si este grupo esta hacia abajo.
Nota: Los
sustituyentes que están a la derecha en un proyección de Fisher,
están “hacia abajo” en la formula de Haworth correspondiente;
aquellos a la izquierda están “hacia arriba”.
De la misma manera
las aldopentosas tienen el potencial para formar un hemiacetal
cíclico de 6 vértices, llevando así a las formas α y β-piranosa.
Las aldohexosas,
como la D-glucosa, son capaces de tener dos formas de furanosa (α y
β) y dos formas de piranosa (α y β). Debido a que normalmente los
anillos con 6 miembros están menos tensionados que los de 5, las
formas de piranosa existen en mayores cantidades que las de furanosa
en equilibrio, y la concentración de la forma de cadena abierta es
bastante pequeña.
5.1. Síntesis de glicósidos
Los glicósidos son derivados de carbohidratos, que se caracterizan por la sustitución del grupo hidroxilo anomérico por algún otro sustituyente. Los glicósidos se llaman O-glicósidos, N-glicósidos, S-glicósidos, etc., según sea el átomo unido al carbono anomérico.

La preparación de los glicósidos en el laboratorio se efectúa dejando que reaccione un carbohidrato con un alcohol, en presencia de un catalizador ácido. A pesar de la presencia de varios otros grupos hidroxilo en el carbohidrato, sólo se reemplaza el grupo hidroxilo
anomérico.
5.2 Reducción de los carbohidratos

El grupo carbonilo
puede ser reducido a una función alcohol. Los procedimientos
seguidos son principalmente dos: hidrogenación catalítica y
reducción con borohidruro de sodio. A los productos de la
reducción de los carbohidratos se les llama alditoles.
5.3 Oxidación de carbohidratos
Una propiedad característica de la función aldehído es su sensibilidad a la oxidación.
- Síntesis ácidos aldónicos: los derivados de las aldosas en que la función aldehído terminal se oxida hasta ácido carboxílico se llaman ácidos aldónicos.La oxidación de las aldosas con bromo es el método que se usa con más frecuencia para preparar ácidos aldónicos,e implica la forma furanosa o piranosa del carbohidrato.
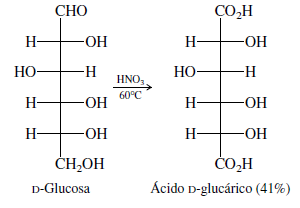
- Síntesis ácidos aldáricos: la reacción de las aldosas con ácido nítrico lleva a la formación de ácidosaldáricos por oxidación tanto del aldehído como de la función alcohol primario terminal, para formar grupos de ácidos carboxílicos. Los ácidos aldáricos también se llaman ácidos sacáricos. Los ácidos urónicos tienen un estado de oxidación entre los ácidos aldónicos y aldáricos. Tienen una función aldehído en un extremo de su cadena de carbonos, y un grupo ácido carboxílico en el otro.
5.4 Formación de cianhidrinas y extensión de la cadena
La presencia de una función aldehído en su forma de cadena abierta hace que las aldosas sean reactivas ante la adición nucleofílica de cianuro de hidrógeno. Esta adición produce una mezcla de cianhidrinas diasteroméricas. Después de formar la cianhidrina, los grupos ciano se convierten en funciones aldehído por hidrogenación en solución acuosa.
El uso de un catalizador envenenado de paladio sobre sulfato de bario evita que la reducción se prolongue hasta los alditoles.5.5. Reacciones del grupo hidroxilo
Los grupos alcohol de los carbohidratos participan en reacciones químicas típicas de las funciones
hidroxilo.
- Acilación: la esterificación de los grupos hidroxilo disponibles se efectúa cuando los carbohidratos se tratan con cloruros de acilo y con anhídridos de ácidos carboxílicos.

- Alquilacion: Los halogenuros de alquilo reaccionan con los carbohidratos y forman éteres en los grupos hidroxilo disponibles. Es una aplicación de la síntesis de Williamson de éteres a los carbohidratos.

6. Importancia disacáridos y polisacáridos
6.1 Disacaridos
Los disacáridos son carbohidratos que forman dos moléculas de monosacárido al hidrolizarse. Estructuralmente, los disacáridos son glicósidos en los que el grupo alcoxi unido al carbono anomérico se deriva de una segunda molécula de azúcar. Son sólidos cristalinos de color blanco, sabor dulce y solubles en agua.
Los principales disacáridos de interés biológico son:
- Sacarosa (azúcar común): es el disacárido más presentes en la dieta humana y está formado por la unión de una glucosa y una fructosa en sus carbonos anoméricos por un enlace glicosídico. Su función es endulzar los alimentos para que tengan un mejor gusto. Es el edulcorante mas utilizado del mundo y los fabricantes lo añaden en los caramelos, helados, galletas, pasteles, panes y alimentos enlatados.
- Lactosa: formada por la unión de una glucosa y una galactosa. La lactosa, también llamada azúcar de la leche, es la fuente de la energía nutricional para bebés durante la lactancia. La lactosa hace que la leche sepa dulce y es un ingrediente en muchos alimentos procesados que contienen productos lácteos. La lactosa requiere que el organismo tenga una enzima llamada lactasa para digerir el disacárido. Muchas personas son intolerantes a la lactosa y no producen cantidades suficientes de lactasa para digerir la lactosa, provocando síntomas tales como náuseas, diarrea, gases, cólicos abdominales y flatulencia.
- Maltosa: formada por la unión de dos glucosas. La maltosa no tiene una función específica en el cuerpo. Los fabricantes convierten la maltosa a un alcohol de azúcar disacárido llamado maltilol para su uso como un edulcorante a granel en polvo y en jarabe y se añade a muchos alimentos sin sacarosa y para diabéticos, incluyendo chocolates, goma de mascar, productos de panadería, helados y mermeladas. El organismo absorbe lentamente sólo del 50 al 60 por ciento de maltilol, excretando el resto o fermentándolo en el intestino grueso.

6.2. Polisacáridos
Los polisacáridos están formados por la unión de centenares de monosacáridos, unidos por enlaces O-glicosídicos. Son sustancias de gran tamaño y peso molecular. Son totalmente insolubles en agua y no tienen sabor dulce.
Los principales polisacáridos son:
- Almidón: es el polisacárido de reserva proprio de los vegetales, pues sirve como almacén de la glucosa fabricada por fotosíntesis. Está formado a su vez por dos componentes, amilosa y amilopectina, en proporciones variables, según la especie vegetal de la que se trate.
- Glucógeno: al igual que el almidón, es un polímero ramificado de alfa-glucosa. Éste es un polisacárido de reserva propio de los animales; abundante en hígado y músculos, donde proporciona glucosa como combustible para la contracción muscular, mientras que el del hígado es la reserva general de glucosa que pasa a la sangre y se distribuye a las células.
- Celulosa: es un polisacárido con función esquelética o estructural. Este compuesto constituye el elemento principal de la pared celular bacteriana. Las cadenas de celulosa se disponen paralelamente, uniéndose por puentes de hidrógeno y formando microfibrillas que, a su vez, se agrupan en macrofibrillas. El tipo de enlace químico hace que esta sea inatacable por las enzimas digestivas humanas, por lo que no posee interés alimenticio para el hombre. Ademas es un polisacárido rígido, insoluble, que contiene desde cientos hasta vario miles de unidades de glucosa.
7. Bibliografía
- Carey, F. (2006). Carbohidratos. En Química orgánica (6ed.). Mexico, D.F., MEXICO: McGraw-Hill/Interamericana Editores, de C.V.
- McMurry, J. (2008). Biomoléculas: Carbohidratos. En Química orgánica (7ed.). Mexico, D.F., MEXICO: Cengage Learning Editores, S.A.
- Carbohidratos. (2004). Facultad de Ciencias Médicas, Universidad de San Carlos de Guatemala. Retrieved from http://medicina.usac.edu.gt/quimica/biomol/carbo.htm











No hay comentarios:
Publicar un comentario