Aminoácidos, péptidos y proteínas
1. Defnición
Como
su nombre indica los aminoácidos son compuestos que poseen un grupo amino
(-NH2), un grupo ácido carboxílico (-COOH) y un radical
variable R en su estructura. Son los precursores de los péptidos y las proteínas, y en ellos el
grupo amino y el grupo carboxilo, se encuentran unidos al mismo átomo de
carbono, conocido como carbono-α (α-aminoácidos).
Para propósitos de clasificación, las cadenas con menos de 50 aminoácidos con frecuencia se llaman péptidos, mientras que el término proteína se utiliza para cadenas más grandes. El carbono-α (a excepción de la glicina) es un carbono quiral y como tal presenta los dos enantiómeros L y D. Los 20 α-aminoácidos presentes en las proteínas sen de la serie L.
Para propósitos de clasificación, las cadenas con menos de 50 aminoácidos con frecuencia se llaman péptidos, mientras que el término proteína se utiliza para cadenas más grandes. El carbono-α (a excepción de la glicina) es un carbono quiral y como tal presenta los dos enantiómeros L y D. Los 20 α-aminoácidos presentes en las proteínas sen de la serie L.
2. Clasificación
2.1. Aminoácidos
2.1. Aminoácidos
Según la naturaleza del grupo -R, o cadena lateral, los aminoácidos pueden ser
clasificados en cuatro grandes grupos:
 Son 8 los aminoácidos que se clasifican
como poseedores de cadenas laterales no polares. La alanina, valina, leucina e
isoleucina, poseen cadenas laterales de hidrocarburos alifáticos. La metionina
posee una cadena lateral de éter tiólico (C-S-C). La prolina es el único
aminoácido cíclico, pues el grupo -R se cierra sobre el N del grupo α-amino. Por su parte, la fenilalanina y el
triptófano contienen grupos aromáticos.
Son 8 los aminoácidos que se clasifican
como poseedores de cadenas laterales no polares. La alanina, valina, leucina e
isoleucina, poseen cadenas laterales de hidrocarburos alifáticos. La metionina
posee una cadena lateral de éter tiólico (C-S-C). La prolina es el único
aminoácido cíclico, pues el grupo -R se cierra sobre el N del grupo α-amino. Por su parte, la fenilalanina y el
triptófano contienen grupos aromáticos.
- Neutros o apolares
 Son 8 los aminoácidos que se clasifican
como poseedores de cadenas laterales no polares. La alanina, valina, leucina e
isoleucina, poseen cadenas laterales de hidrocarburos alifáticos. La metionina
posee una cadena lateral de éter tiólico (C-S-C). La prolina es el único
aminoácido cíclico, pues el grupo -R se cierra sobre el N del grupo α-amino. Por su parte, la fenilalanina y el
triptófano contienen grupos aromáticos.
Son 8 los aminoácidos que se clasifican
como poseedores de cadenas laterales no polares. La alanina, valina, leucina e
isoleucina, poseen cadenas laterales de hidrocarburos alifáticos. La metionina
posee una cadena lateral de éter tiólico (C-S-C). La prolina es el único
aminoácido cíclico, pues el grupo -R se cierra sobre el N del grupo α-amino. Por su parte, la fenilalanina y el
triptófano contienen grupos aromáticos.- Polares sin carga
Siete son los α-aminoácidos cuyo resto -R
es polar pero sin carga. La glicina posee la cadena más simple, un átomo de
hidrógeno. La serina y la treonina son portadores de un grupo hidroxilo (-OH).
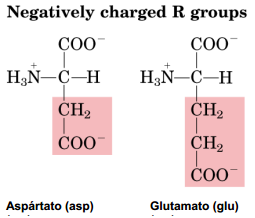
La asparragina y la glutamina, poseen cadenas laterales portadoras de un grupo
amida, y por hidrólisis dan lugar, respectivamente, a aspartato y glutamato,
dos aminoácidos con carga negativa. La tirosina posee un grupo fenólico y la
cisteína debe su polaridad a la presencia de un grupo tiólico (-SH).
- Polares con carga negativa
- Polares con carga positiva
Dentro del conjunto de los aminoácidos naturales, existen unos que pueden ser sintetizados por las células humanas a partir de otras sustancias, pero también hay aminoácidos que deben ser incluidos en la dieta, ya que nuestras células no pueden sintetizarlos o, cuando menos, no en cantidad suficiente para satisfacer la demanda del organismo; se conocen con el nombre de aminoácidos esenciales y son valina, leucina, isoleucina, treonina, motionina, fenilalanina, triptófano y lisina.
2.2. Péptidos y proteínas
Los péptidos y las proteínas son polímeros de aminoácidos, los cuales están unidos mediante un enlace amida (-CO-NH-). Este enlace ocurre gracias a la perdida de una molécula de agua y recibe el nombre de enlace peptídico.
Según el número de aminoácidos que se enlazan se pueden clasificar los péptidos como:
Según el número de aminoácidos que se enlazan se pueden clasificar los péptidos como:
- Oligopéptidos: menos de 10 aminoácidos
- Polipeptidos: entre 10 y 100 aminoácidos
- Proteínas: más de 100 aminoácidos
Además, según su conformación las proteínas pueden clasificarse en:
- Fibrosas: poseen las cadenas polipeptídicas ordenadas de modo paralelo a lo largo de un eje, forman materiales físicamente resistentes e insolubles en agua, siendo elementos básicamente estructurales como por ejemplo la α-queratina del pelo, la fibroina de la seda o el colágeno de los tendones.
- Globulares: están constituidas por una o varias cadenas polipeptídicas plegadas de modo que puedan adoptar una conformación esférica o globular. Desempeñan diferentes funciones, entre ellas: -proteínas transportadoras (mioglobina); - catalizadores (enzimas); - protectora (anticuerpos); - receptoras de señal (rodopsina); - reserva (albumina).
3. Aminoácidos y punto isoeléctrico
La característica más llamativa de los aminoácidos es la presencia en una misma molécula de grupos ácidos (-COOH) y grupos básicos (-NH2). Por lo tanto, en medio ácido se comportan como bases, y en medio básico se comportan como ácidos. Las moléculas que presentan esta característica se dice que son anfóteras.
En medios ácidos fuertes, tanto el grupo amino como el grupo ácido se encuentran protonados. Al subir el pH se desprotona el grupo más ácido, H de menor pKa, formándose una especie neutra llamada zwitterión. Suubiedo aún más el pH, el grupo amino pierde el protón, dando lugar a la especie desprotonada.

La característica más llamativa de los aminoácidos es la presencia en una misma molécula de grupos ácidos (-COOH) y grupos básicos (-NH2). Por lo tanto, en medio ácido se comportan como bases, y en medio básico se comportan como ácidos. Las moléculas que presentan esta característica se dice que son anfóteras.
En medios ácidos fuertes, tanto el grupo amino como el grupo ácido se encuentran protonados. Al subir el pH se desprotona el grupo más ácido, H de menor pKa, formándose una especie neutra llamada zwitterión. Suubiedo aún más el pH, el grupo amino pierde el protón, dando lugar a la especie desprotonada.

Existe entonces un pH para el cual la carga eléctrica neta de las moléculas es cero y la concentración del zwitterión es máxima. Este pH se llama punto isoeléctrico (pI). El pI es el pH en que la molécula se disocia por igual en ambos sentidos y se obtiene por la semisuma de los pKa.
4. Enzimas
4.1. Definición
Un enzima es una proteína grande que usualmente actúa como catalizador para una reacción biológica. Una enzima no ocasiona un cambio químico desfavorable, sino que únicamente actúa para disminuir la energía de activación de la reacción, para que ésta suceda más rápidamente. A diferencia de muchos catalizadores, las enzimas usualmente son específicas en su acción; de hecho, una enzima únicamente catalizará una sola reacción de un único compuesto, llamado sustrato de la enzima.
4.2. Clasificación
Las enzimas se clasifican dependiendo del tipo de reacción que catalizan en:
Un enzima es una proteína grande que usualmente actúa como catalizador para una reacción biológica. Una enzima no ocasiona un cambio químico desfavorable, sino que únicamente actúa para disminuir la energía de activación de la reacción, para que ésta suceda más rápidamente. A diferencia de muchos catalizadores, las enzimas usualmente son específicas en su acción; de hecho, una enzima únicamente catalizará una sola reacción de un único compuesto, llamado sustrato de la enzima.
4.2. Clasificación
Las enzimas se clasifican dependiendo del tipo de reacción que catalizan en:
- Oxidorreductoras: catalizan reacciones de oxidoreducción, es decir, de tranferencia de hidrógeno (H) o de electrones de un sustrato a otro. Entran en esta categoría las enzimas llamadas comúnmente deshidrogenasas, reductasas, oxidasas, oxigenasas, hidroxilasas y catalasas.
- Transferasas: catalizan varios tipos de transferencia de grupos de una molécula a otra (transferencia de grupos amino, carboxilo, carbonilo, metilo, glicosilo, acilo, fosforilo). Pertenecen a esta categoría cinasas (transferencia grupo fosfato) y transaminasas (transferencia grupo amino)
- Hidrolasas: catalizan reacciones de hidrolisís de ésteres (lipasas), amidas (proteasas) y sustratos relacionados. Pertenece a esta categoría la lactasa que cataliza la reacción "lactosa + agua → glucosa + galactosa"
- Liasas: catalizan la eliminación o la adición de moléculas pequeñas como H2O de o a un sustrato. Pertenecen a esta categoría las deshidrasas (perdida de H2O), las aldolasas y las descarboxilasas (perdida de CO2), en particular la acetacetato descarboxilasa cataliza la reacción "ácido acético ↔ CO2 + acetona"
- Isomerasas: catalizan la interconversión de isómeros. Pertenecen a esta categoría las epimerasas (isomerización del centro quiral), las racemasas, las mutarasas. Un ejemplo es la fosfoglucosa isomerasa que permite la reacción "glucosa-6-fosfato ↔ fructosa-6-fosfato"
- Ligasas: catalizan la formación de enlace entre C y O,S,N y otros átomos. Generalmente, la energía requerida para la formación del enlace deriva de la hidrólisis de ATP. Ejemplos son las sintetasas (formación de un nuevo enlace) y las carboxilasas (adición de CO2).
Finalmente, además de su parte proteínica, la mayor parte de las enzimas también contiene una pequeña parte no proteínica llamada cofactor, el cual puede ser un ion inorgánico, como Zn2+, o una molécula pequeña, llamada coenzima.
5. Bibliografía
5. Bibliografía
- Aminoácidos y péptidos. Universidad de Huelva. (2012). Retrieved from http://tuylaquimica.files.wordpress.com/2012/02/aminoc3a1cidos-y-protec3adnas.pdf
- Proteínas. Universidad de Huelva. (2005). Retrieved from http://www.uhu.es/08007/documentos%20de%20texto/apuntes/2005/pdf/Tema_05_proteinas.pdf
- Aminoácidos y proteínas. Retrieved from http://www.ehu.es/biomoleculas/buffers/buffer3.htm
- Fernández, G. (2009, February 1). QUÍMICA ORGÁNICA. Retrieved from http://www.quimicaorganica.org/aminoacidos-peptidos/528-aminoacidos-punto-isoelectrico.html
- McMurry, J. (2008). Biomoléculas: Aminoácidos, péptidos y proteínas. En Química orgánica (7a. ed.). Mexico, D.F., MEXICO: Cengage Learning Editores, S.A.
- Clasificación general de las enzimas. Universidad de Chile. Retrieved from http://mazinger.sisib.uchile.cl/repositorio/lb/ciencias_quimicas_y_farmaceuticas/schmidth02/parte03/01.html





No hay comentarios:
Publicar un comentario